
产品货号:
YTC1101
中文名称:
细菌内毒素检测试剂盒(鲎试剂法)
英文名称:
Chromogenic LAL Endotoxin Assay Kit
产品规格:
160T
发货周期:
1~3天
产品价格:
询价

本制品是一种基于鲎试剂酶促反应原理定量检测细菌内毒素也称脂多糖的试剂盒,稳定性高,抗干扰能力强,且可以检测微量样品,样品的用量可以仅为10μL或更小体积。

- 溶液样品中内毒素污染检测;
- 各种不同类型样品中内毒素含量的定量检测。

鲎试剂为鲎科动物东方鲎的血液变形细胞裂解物的冷冻干燥品或体外重组的同类试剂,鲎试剂中含有C因子、B因子、凝固酶原、凝固蛋白原等。在适宜的条件下(温度,pH值及无干扰物质),内毒素激活C因子,引起一系列酶促反应,激活凝固酶原形成凝固酶,凝固酶分解本试剂盒中提供的显色剂,使其分解为多肽和黄色的对硝基苯胺(pNA,λmax =405nm)。在一定时间内,pNA的生成量与内毒素浓度成正相关。同时,对硝基苯胺(pNA)也可与偶氮化试剂反应生成玫瑰红色产物(λmax =545nm),据此可以定量待测样品的内毒素浓度,并可避免待测样品本身的颜色对405nm处吸收峰的干扰。

- 本试剂盒首次启用后,适当保存至少在2个月内有效。基于鲎试剂的内毒素检测试剂盒,通常只能配制后立即使用,导致试剂盒的浪费。本试剂盒经过精心优化,确保首次配制成溶液后,按照说明书推荐的方法保存,至少2个月内有效。
- 本试剂盒检测时间短,样品需求量小。检测试剂加入到待测样品中最快16分钟左右,即可完成显色反应,从而实现简单、快速、高灵敏地检测内毒素含量;不依赖凝固蛋白形成凝胶,抗干扰能力强,可适用于本底颜色为淡黄色的样本,如血浆、血清等;对待测样品消耗量小,每个反应体系仅需使用10μL待测样品;含有偶氮化试剂,检测灵敏度高、测定样品的线性范围宽,并且可避免有色检品自身颜色对检测的干扰。
- 检测灵敏度高。最低检测限可以达到0.01EU,可以自行选择的有效检测区间为0.1E -1.0EU/mL或0.01 -0.10EU/mL。具体的检测效果请参考图1。
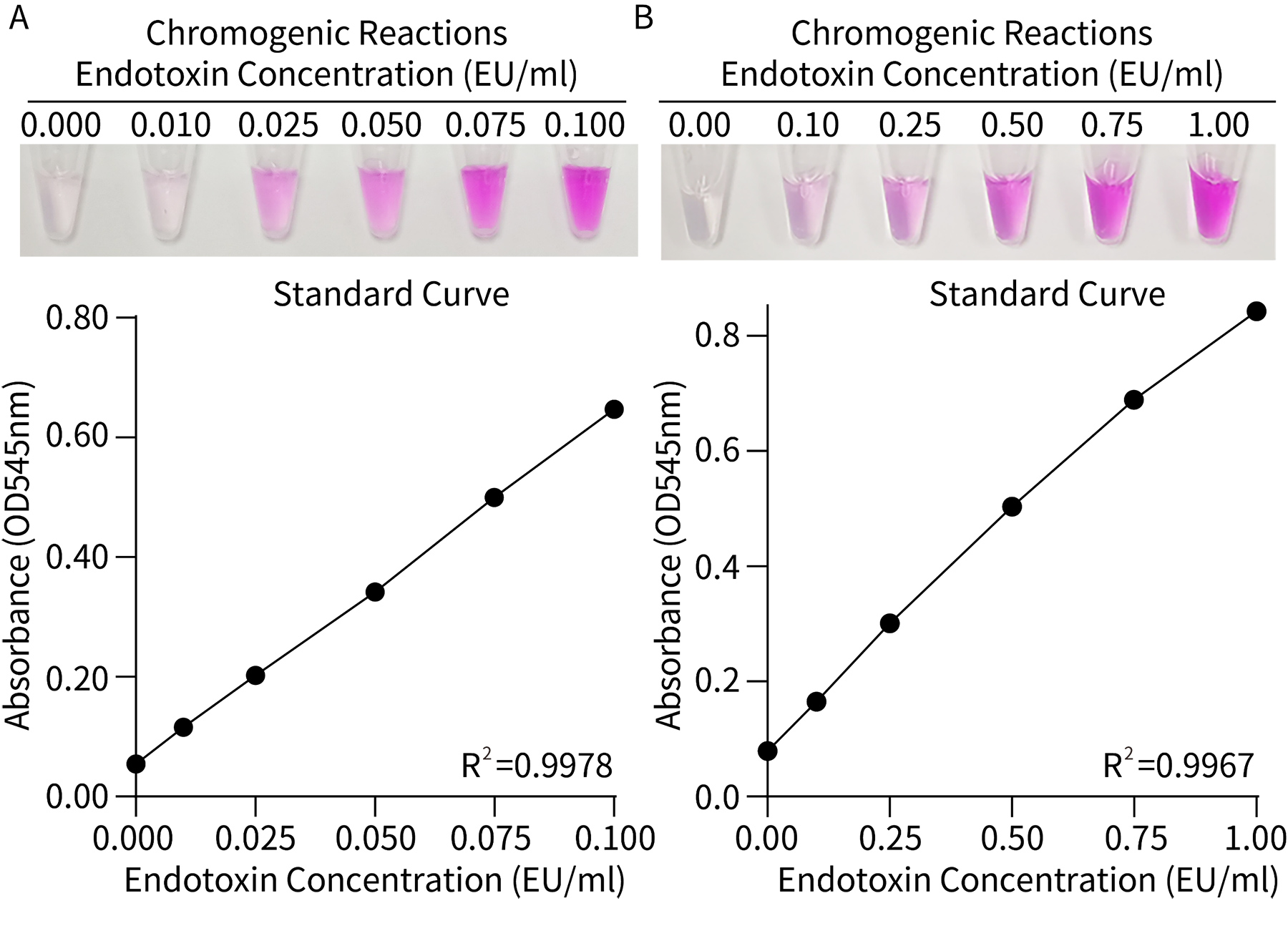
图1.本试剂盒检测标准曲线的效果图。取配制好的下列浓度的内毒素标准品溶液:0.000、0.010、0.025、0.050、0.075、0.100EU/mL (A)及0.00、0.10、0.25、0.50、0.75、1.00EU/mL (B)各10μL,用本试剂盒进行显色反应及标准曲线的检测。实际检测时会因检测仪器等实验条件的的不同而存在差异,图中数据仅供参考。

| 组分 | 规格 |
| 内毒素标准品(20EU) | 1瓶 |
| 内毒素检测试剂 | 1瓶 |
| 内毒素检测试剂配制液 | 2mL |
| 显色剂 | 1瓶 |
| Buffer A | 1瓶 |
| Buffer B | 1瓶 |
| Buffer C | 1瓶 |
| 内毒素检测用水 | 50mL |
保存:2~8℃,有效期2年。

- 内毒素检测试剂溶解后很不稳定,需要尽量在10分钟内使用完毕或适当分装后保存。因此试剂盒在使用过程中需要预先做好各项准备工作,在需要加入内毒素检测试剂前再溶解内毒素检测试剂,或解冻之前分装冻存的内毒素检测试剂。
- 本制品所提供的内毒素检测用水请在首次开启后建议立即使用完毕,或务必在无内毒素实验条件下,使用无内毒素实验耗材对其适当分装并保存于-20℃。常规实验室条件下,反复多次取用同一容器中的内毒素检测用水,极易因环境因素造成内毒素的污染。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或自行准备的确保无内毒素的超纯水进行内毒素检测所需试剂的溶解和配制,以免造成试剂的内毒素污染。
- 所有内毒素检测的实验过程均需在无内毒素条件下,使用无内毒素实验耗材进行,否则极易对内毒素检测造成干扰。
- 实验所用的器皿需经预处理,以去除可能存在的外源性内毒素,常用的方法是在250℃干烤至少60分钟,也可以采用其它确保不干扰细菌内毒素检查的适宜方法。若使用塑料器械,应选用表明无内毒素并且对实验无干扰的器械。
- 实验操作过程应防止微生物的污染。
- 溶解并稀释后的内毒素标准品溶液静置时间若超过10分钟,使用前应在旋涡振荡器上振荡混匀1分钟。冻存的溶解后的内毒素标准品,下次使用时须先充分溶解,并剧烈涡旋混合后使用。
- 本试剂盒中的内毒素检测试剂溶解后,须立即适当分装,-20℃保存一周有效,经液氮速冻后-80℃保存至少两个月有效。务必避免反复冻融。
- 内毒素检测所需试剂在溶解配制好后,如不能一次性使用完,请立即使用无内毒素的耗材进行分装冻存,随用随取。
- 同一管检测试剂在常规实验条件下多次反复取用后,也极易造成环境中内毒素的污染,建议根据实验需求对试剂进行适当分装。
- 推荐设置不添加待测样品的空白对照,以确认整个检测体系是否被环境内毒素所污染。
- 样品的稀释和制备,推荐使用无菌无内毒素超纯水。

以下所有实验操作均须在无内毒素条件下进行,推荐使用无菌吸头,锥形离心管,1.5mL离心管或PCR管等实验耗材进行体外内毒素含量的检测。
- 待测样品的预处理及注意事项
- 待测样品与内毒素检测试剂混合后的溶液的pH值应在6~8之间,若超出此范围,需用不含内毒素的缓冲液、氢氧化钠或盐酸调节pH。
- 若待测样品中可能存在鲎试剂检测的干扰物质,处理方法参见本使用说明第4点“待测样品的干扰实验”。
- 若待测样品中可能含有β-葡聚糖(β-葡聚糖会产生G因子旁路反应,干扰内毒素检测),需选用特异性内毒素检测试剂。
- 若待测样品为一些抗菌素如头孢类抗菌素和磺胺制剂会干扰显色反应。
- 若待测样品的本底吸光度值大于0.5,必须对待测样品适当稀释后再检测。
- 若待测样品颜色较深(例如溶血),或在酸性条件下颜色加深(例如一些组织培养介质)必须设置待测样品空白管以扣除待测样品自身的颜色本底。
- 请务必使用首次开启的内毒素检测用水或分装后确保无内毒素污染的内毒素检测用水,或者自行准备确保无内毒素的超纯水进行待测样品的稀释,以免干扰内毒素检测结果。
- 待测样品空白管不加入内毒素检测试剂,以等体积溶剂(该处为内毒素检测用水)代替。其余操作同待测样品管。
- 接触检测试剂及待测样品的所有器皿必须是无内毒素的。
- 如需使用玻璃器皿,可经250℃干烤至少60分钟以去除内毒素后再进行使用。
- 接触检测试剂及待测样品的所有器皿必须是无内毒素的。
- 待测样品与内毒素检测试剂混合后的溶液的pH值应在6~8之间,若超出此范围,需用不含内毒素的缓冲液、氢氧化钠或盐酸调节pH。
- 实验操作
- 内毒素标准品溶液的配制:标准曲线所采用的内毒素浓度可以为0.010、0.025、0.050、0.100EU/mL或0.10、0.25、0.50、1.00EU/mL等。稀释方法如下:取试剂盒提供的内毒素标准品1瓶(20EU),确认内毒素标准品粉末在瓶底部,如果顶部有粉末可以轻轻敲击安瓿瓶底部使用粉末坠落;加入1mL内毒素检测用水,静置约半分钟,反复抽吸数次后转移到一无内毒素1.5mL离心管内;放置于旋涡混匀器上振荡2~3分钟以充分溶解并混匀内毒素标准品。将上述配制好的20EU/mL内毒素标准品溶液进一步用内毒素检测用水逐步稀释为0.1EU/mL和1.0EU/mL的内毒素溶液。
随后以0.1EU/mL的内毒素溶液为母液按照下表依次稀释成浓度为0.010、0.025、0.050、0.100EU/mL的内毒素溶液。
或以1.0EU/mL的内毒素溶液为母液按照下表依次稀释成浓度为0.10、0.25、0.50、1.00EU/mL的内毒素溶液。内毒素浓度(EU/mL) 内毒素检测用水(mL) 0.1EU/mL内毒素溶液(mL) 0.100 0.00 1.00 0.050 0.50 0.50 0.025 0.75 0.25 0.010 0.90 0.10 内毒素浓度(EU/mL) 内毒素检测用水(mL) 1EU/mL内毒素溶液(mL) 1.00 0.00 1.00 0.50 0.50 0.50 0.25 0.75 0.25 0.10 0.90 0.10 - 每稀释一步均应在旋涡振荡器上剧烈振荡至少20秒。
- 若稀释好的内毒素溶液静置时间超过10分钟,需在旋涡混匀器上剧烈振荡1分钟以充分混匀后使用。
- 配制好的低浓度内毒素标准溶液应在4小时内用完。
- 为确保稀释的准确性,每一步稀释的稀释倍数不得超过10倍。
- 每稀释一步均应在旋涡振荡器上剧烈振荡至少20秒。
- 阴性对照为内毒素检测用水。
- 内毒素检测试剂、显色剂、Buffer A、B和C的溶解。
① 内毒素检测试剂:在试剂盒提供的内毒素检测试剂瓶内加入1.7mL内毒素检测试剂配制液,轻轻混匀使其完全溶解,静置20秒后使用。- 不可进行涡旋混合等方式激烈振荡,以避免检测试剂失活。
- 溶解好的内毒素检测试剂溶液应尽量在10分钟内用完,否则可能会影响检测效果。
- 如果溶解好的内毒素检测试剂溶液不会一次性全部用完,可以立即适当分装,-20℃保存一周有效,-80℃保存至少两个月有效。
- 显色剂溶液在无污染的条件下于4℃保存一周内有效,-20℃保存至少半年有效。
④ Buffer A:加10mL反应终止剂至Buffer A中,充分溶解并混匀。内毒素检测用水 12M HCl 反应终止液 10mL 0.4mL 10.4mL
⑤ Buffer B:加10mL内毒素检测用水至Buffer B中,充分溶解并混匀。
⑥ Buffer C:加10mL内毒素检测用水至Buffer C中,充分溶解并混匀。- 配制好的Buffer A、B和C溶液,4℃保存一周内有效,-20℃保存至少半年有效。
- 不可进行涡旋混合等方式激烈振荡,以避免检测试剂失活。
- 待测样品内毒素含量检测参照下表进行。
具体操作步骤如下:试剂 阴性对照 内毒素标准 待测样品 内毒素检测用水(μL) 10 内毒素标准品溶液(μL) 10 待测样品(μL) 10 内毒素检测试剂溶液(μL) 10 10 10 混匀,37℃孵育T1分钟 显色剂溶液 10 10 10 混匀,37℃孵育T2分钟 Buffer A溶液(μL) 50 50 50 混匀,Buffer B溶液(μL) 50 50 50 混匀,Buffer C溶液(μL) 50 50 50 混匀,静置5分钟,于545nm波长处读取吸光度
① 取无内毒素离心管或PCR管,加入10μL内毒素检测用水、内毒素标准品溶液或待测样品。
② 再加入10μL内毒素检测试剂溶液,混匀,盖上铝箔纸,37℃避光孵育T1分钟。
③ 孵育结束,加入10μL显色剂溶液,混匀,37℃孵育T2分钟。
④ 孵育结束,加入50μL Buffer A溶液,混匀。
⑤ 加入50μL Buffer B溶液,混匀。
⑥ 加入50μL Buffer C溶液,混匀,静置5分钟,使用分光光度计或酶标仪在545nm波长处读取吸光度值。显色反应结束到读取吸光度值的时间不应超过5小时。- 待测样品中内毒素含量约在0.1~1.0EU/mL范围内时,37℃孵育时间推荐使用T1为9分钟,T2为6分钟。
- 待测样品中内毒素含量约在0.01~0.10EU/mL范围内时,37℃孵育时间推荐使用T1为25分钟,T2为6分钟。
- 对于内毒素含量极低的待测样品,也可适当延长T1孵育时间以增强样品的显色效果,提高545nm波长处吸光度值的测定准确性。
- 以上混匀操作均可轻晃离心管2~3次以达到混匀目的,无需漩涡振荡。
- 待测样品中内毒素含量约在0.1~1.0EU/mL范围内时,37℃孵育时间推荐使用T1为9分钟,T2为6分钟。
- 内毒素标准品溶液的配制:标准曲线所采用的内毒素浓度可以为0.010、0.025、0.050、0.100EU/mL或0.10、0.25、0.50、1.00EU/mL等。稀释方法如下:取试剂盒提供的内毒素标准品1瓶(20EU),确认内毒素标准品粉末在瓶底部,如果顶部有粉末可以轻轻敲击安瓿瓶底部使用粉末坠落;加入1mL内毒素检测用水,静置约半分钟,反复抽吸数次后转移到一无内毒素1.5mL离心管内;放置于旋涡混匀器上振荡2~3分钟以充分溶解并混匀内毒素标准品。将上述配制好的20EU/mL内毒素标准品溶液进一步用内毒素检测用水逐步稀释为0.1EU/mL和1.0EU/mL的内毒素溶液。
- 数据处理
建立标准曲线:Y = bX + a,其中Y为545nm处吸光度值,X为内毒素的浓度,b为标准曲线斜率,a为Y轴截距。使用本制品进行显色反应的效果及标准曲线的检测效果请参考图1。当检测数据同时满足如下三个条件时获得的检测结果才有效:- 标准曲线的浓度点≥3(相邻浓度间稀释倍数不得大于10),标准曲线的相关系数R2≥0.980。
- 标准曲线最低点的Y值大于阴性对照的Y值。
- 待测样品的吸光度值在标准曲线的区间内。
- 制作内毒素含量在0.01~0.10EU/mL范围内的标准曲线时,阴性对照的吸光度值通常需小于0.2,0.1EU/mL的标准内毒素溶液吸光度值通常需大于0.5。
- 制作内毒素含量在0.1EU/mL~1.0EU/mL范围内的标准曲线时,阴性对照的吸光度值通常需小于0.2,1.0EU/mL的标准内毒素溶液吸光度值通常需大于0.75。
- 制作内毒素含量在0.01~0.10EU/mL范围内的标准曲线时,阴性对照的吸光度值通常需小于0.2,0.1EU/mL的标准内毒素溶液吸光度值通常需大于0.5。
- 标准曲线的浓度点≥3(相邻浓度间稀释倍数不得大于10),标准曲线的相关系数R2≥0.980。
- 待测样品的干扰实验
待测样品的干扰实验详见《中华人民共和国药典》2015版中《细菌内毒素检查法》的“光度测定法干扰实验”。具体操作步骤如下:- 选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为待测样品干扰实验中添加的内毒素浓度,配制含浓度为λm的内毒素的待测样品作为阳性对照,测量出该溶液的内毒素浓度,称为Cs。
- 测量出未添加外源内毒素的待测样品溶液内毒素浓度,称为Ct。
- 计算该实验条件下的回收率R=(Cs-Ct)/λm×100%。
- 当R在50%~200%之间,则认为在此实验条件下待测样品溶液不存在干扰作用。
- 当R在50%~200%之外,需对待测样品进行系列稀释(稀释倍数不得超过最大有效稀释倍数MVD)或进行其它处理消除干扰,每一稀释溶液都需重复步骤a-c,直到内毒素的回收率R在50%~200%之间。选择回收率R最接近100%的稀释倍数进行待测样品内毒素含量的检测。
- MVD=cL/λ,该公式中L为待测样品的细菌内毒素限值;c为待测样品溶液的浓度,当L以EU/mg或EU/U表示时,c的单位需为mg/ml或U/ml,当L以EU/mL表示时,则c等于1.0mL/mL。如需计算在MVD时的待测样品浓度,即最小有效稀释浓度,可使用公式c=λ/L;λ为在凝胶法中鲎试剂的标示灵敏度(EU/mL)或是在光度测定法中所使用的标准曲线上最低的内毒素浓度。
- 选择标准曲线中点或一个靠近中点的内毒素浓度(设为λm),作为待测样品干扰实验中添加的内毒素浓度,配制含浓度为λm的内毒素的待测样品作为阳性对照,测量出该溶液的内毒素浓度,称为Cs。

- 什么原因会造成标准曲线的检测效果不好?
有以下原因会影响标准曲线的制作:- 本制品可做两条标准曲线,内毒素浓度范围分别为0.1~1.0EU/mL或者0.01~0.10EU/mL。若使用内毒素标准品配制的内毒素溶液的浓度不在此范围内,则会影响标准曲线的准确度。
- 仔细阅读说明书,确保操作步骤无误,数据计算准确!
- 确定配制的内毒素标准品溶液是否充分振荡混合均匀。推荐使用漩涡振荡器对内毒素溶液进行振荡混匀。
- 确定内毒素检测试剂是否完全溶解并混匀。且内毒素检测试剂要在10分钟内用完,否则会影响检测效果。因此需先完成内毒素标准品溶液的配制工作和待测样品的准备工作,再溶解内毒素检测试剂。同时内毒素检测试剂溶解后需轻轻混匀并静置20秒再进行使用。
- 精确控制孵育时间。多个样品同时进行检测时,每一步均要求尽快完成加样操作,并避免污染。
- 精确控制孵育温度。推荐选择水浴进行孵育。
- 本制品可做两条标准曲线,内毒素浓度范围分别为0.1~1.0EU/mL或者0.01~0.10EU/mL。若使用内毒素标准品配制的内毒素溶液的浓度不在此范围内,则会影响标准曲线的准确度。
- 如何检测内毒素含量未知的样品?
对于内毒素含量未知的样品的检测,需先做预实验大致确定样品中内毒素的浓度范围。建议先做0.1~1.0EU/mL标准曲线来确定样品内毒素浓度范围。如果检测出样品内毒素浓度超过标曲上限,则选择对样品稀释后再进行检测;若检测出样品内毒素浓度超过标曲下限,则选择制作并使用0.01~0.10EU/mL浓度范围内的标准曲线进行检测。大致确定待测样品的内毒素浓度范围,并选用合适的标准曲线后,待测样品还需做干扰实验以验证实验的可靠性,具体操作请见使用说明中的第4点待测样品的干扰实验部分或参考中国药典中的相关描述。 - 本制品是否适用于血液样品的内毒素检测?
可以。本制品属于含偶氮化试剂显色剂的鲎试剂内毒素含量检测试剂盒,抗干扰能力强,可以用于检测血液样品中的内毒素含量。但需注意,建议使用处理后的全血样品进行内毒素含量的检测,例如:全血经抗凝处理,高速离心后获得的血浆样品;或全血经凝血处理,获得的血清样品。 - 能否使用酶标仪检测反应后样品的吸光度?
可以。在反应完成后,可用分光光度计检测波长545nm处的吸光度,也可吸取150或200μL的显色反应后样品至平底,无色透明的96孔板中,并使用酶标仪进行检测。如无545波长,也可选择使用540nm处波长进行检测。
相关搜索:细菌内毒素检测试剂盒(鲎试剂法),内毒素检测,细菌脂多糖检测,细菌LPS检测,Chromogenic LAL Endotoxin Assay Kit



